NEWS
Fälschungssichere Pharmaverpackungen
GE Pharmaceuticals Ltd. und Wörwag starten Serienproduktion mit Seriennummern: Nach Abschluss der Testphase beginnt die Fertigung gemäß FMD – drei Jahre vor Ablauf der Übergangsfrist für die neue EU-Richtlinie.
Anfang April fiel bei GE Pharmaceuticals Ltd. der Startschuss zur regulären Herstellung fälschungssicherer Pharmaverpackungen mit Seriennummer. Im Auftrag des Pilotkunden Wörwag Pharma GmbH & Co. KG produzierte der österreichisch-bulgarische Dienstleister die ersten Chargen für den europäischen Markt. Damit gehören die Partner zu den ersten Unternehmen in Europa, die serialisierte Verpackungen in Kombination mit einem Tamper-Evidence-Verschluss herstellen – gemäß der ab 2019 geltenden EU-Richtlinie 2011/62/EU. Drei Jahre vor Ablauf der Übergangsfrist setzen sie damit einen technischen Maßstab.
Ab dem 9. Februar 2019 verpflichtet die als "Falsified Medicines Directive" (FMD) bekannte EU-Richtlinie Pharmaproduzenten, serialisierte und fälschungssichere Verpackungen zu produzieren. "Mit Wörwag haben wir nun einen ersten Anwender, der erfolgreich in die FMD-konforme Serienproduktion eingestiegen ist", so Dr. Günter Datz, Geschäftsführer der GE Pharmaceuticals Ltd. "Dank unserer ausgereiften technischen Lösung können wir ab sofort allen interessierten Pharmaherstellern die FMD-konforme Produktion ihrer Sekundärverpackungen anbieten."
Der Verpackungsspezialist betreibt in seinem neu errichteten Werk in Botevgrad bei Sofia sechs Produktionslinien und baut die Kapazitäten weiter aus. Zwei Linien sind bereits auf die FMD-konforme Produktion ausgerichtet, weitere seien im Aufbau.
Im Vorgriff auf die FMD-Richtlinie begann GE zusammen mit dem Pilotkunden frühzeitig, die Produktion neu auszurichten. Von Beginn an mit dabei waren deutsche Dienstleister wie der Maschinenbau-Spezialist Baumer HHS und der Faltschachtellieferant Kroha. Unter Federführung des deutsch-bulgarischen Managementduos von GE, Dr. Günter Datz und Angel Angelov, entwickelte das Projektteam ein neues Verpackungsdesign und passte die Produktionstechnik den neuen Anforderungen an.
"Der Neubau in Botevgrad eröffnete die Chance, die FMD-konforme Herstellung mit State-of-the-art-Technik von Beginn an unter optimalen Bedingungen zu implementieren", sagt Datz. "Wir haben beschlossen, uns im Pilotprojekt gemeinsam mit unserem Produktionsdienstleister GE das notwendige Know-how frühzeitig anzueignen", so Michael Kulmann, Leiter Operativer Einkauf bei der Wörwag Pharma GmbH & Co. KG. "Dadurch machen wir uns mit dem neuen Standard vertraut und haben die Möglichkeit, unser gesamtes Produktportfolio rechtzeitig auf die ab 2019 geltenden Anforderungen umzustellen."
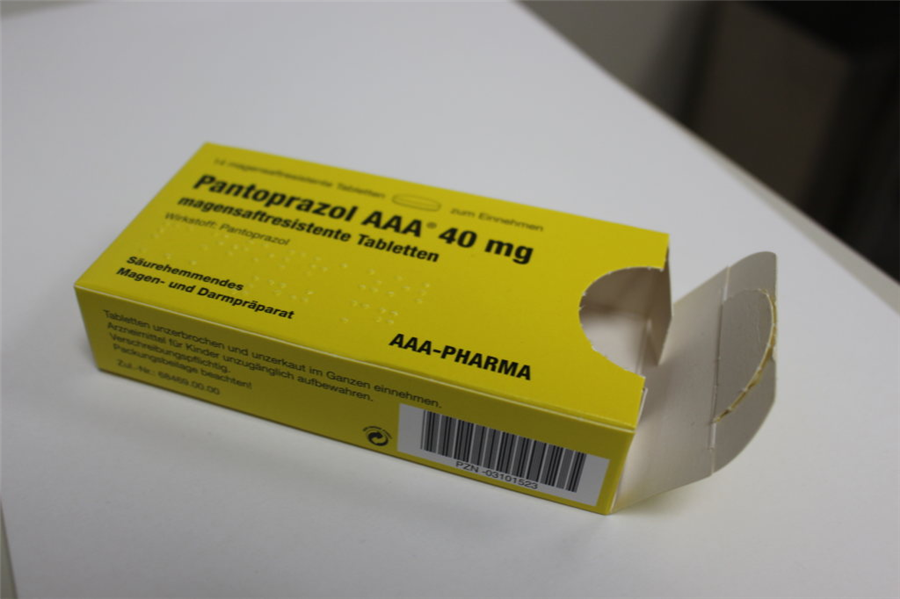
Am 5. April erfolgte die Serienproduktion der ersten Charge serialisierter Medikamente bei GE Pharmaceuticals: 1000 Packungen des Magenmittels "Pantoprazol 40 mg" liefen im Auftrag von Wörwag vom Band. Sowohl die Klebetechnik als auch die Bedruckung bewährten sich beim ersten Produktionslauf und erfüllten sämtliche Anforderungen im Rahmen des Qualitätsmanagements, heißt es. Wörwag will in diesem Jahr bereits rund 150.000 FMD-konforme Sekundärverpackungen von GE herstellen lassen.
Fälschungssicher
Die Faltschachtel für die Sekundärverpackung sollte nutzerfreundlich und wiederverschließbar sein. Die für das Öffnen präferierte Vorderseite ist mit einer nicht erkennbaren Perforierung versehen. Diese befindet sich auf der Oberseite der Verpackung, und wird von der Lasche verdeckt, die dort aufgeklebt wird.
Nach dem ersten Öffnen durch Eindrücken und damit dem Einreißen entlang der Perforation kann die Verpackung auf dieser Seite wieder auf herkömmlichem Wege verschlossen werden, in dem die Lasche wieder unterhalb der Oberseite eingesteckt wird. Für den fälschungssicheren Verschluss entwickelte Baumer HHS eine kombinierte Heiß- und Kaltklebetechnik, die einen fälschungssicheren Verschluss gewährleistet.
2-D-Daten-Matrix-Code
Die Seriennummer wird auf der Rückseite aufgedruckt, und zwar in zweifacher Weise: Sie ist zum einen auf einem quadratischen, maschinenlesbaren 2-D-Matrix-Code hinterlegt und zum anderen unter der Abkürzung "SN" in vom Me-schen lesbarer Schrift. Das selbe gilt auch für den Produktcode, die Chargennummer und das Haltbarkeitsdatum.
All diese Angaben werden gemäß EU-Richtlinie ab 2019 verifiziert: das erste Mal unmittelbar nach dem Aufdrucken auf die Sekundärverpackung, das zweite Mal bei der Ausgabe am Point- of Sale (Apotheke, Krankenhaus usw.). Erst nach erfolgreicher Verifizierung der gültigen Seriennummer und erfolgter Freigabe durch das IT-System darf das pharmazeutische Produkt abgegeben werden.
Full-Service am Produktionsstandort
GE Pharmaceuticals bietet am Standort Botevgrad seit 2006 Dienstleistungen im Zusammenhang mit der Verpackung von Tabletten und Hardgelatinekapseln an. Das Portfolio reicht von der Zollabwicklung über die Durchführung von EU-Retests bis hin zur Primär- und Sekundärverpackung sowie manuellen Umverpackung. Angeboten würden alle erforderlichen Laboranalysen, Stabilitätsuntersuchungen und die Freigabe der verpackten Produkte durch "Qualified Persons".
2006 wurde die GMP-qualifizierte Produktionsstätte vom österreichischen Prüfinstitut AGES erstmals zertifiziert. In den vergangenen Jahren erfolgten Audits und Re-Audits von Kunden sowie der bulgarischen Gesundheitsbehörde.